En breve: El fármaco selectivo BLU-667 muestra una promesa contra los tumores sólidos con alteraciones de RET

En breve: El fármaco selectivo BLU-667 muestra una promesa contra los tumores sólidos con alteraciones de RET

© Can Stock Photo / VIPDesignUSA
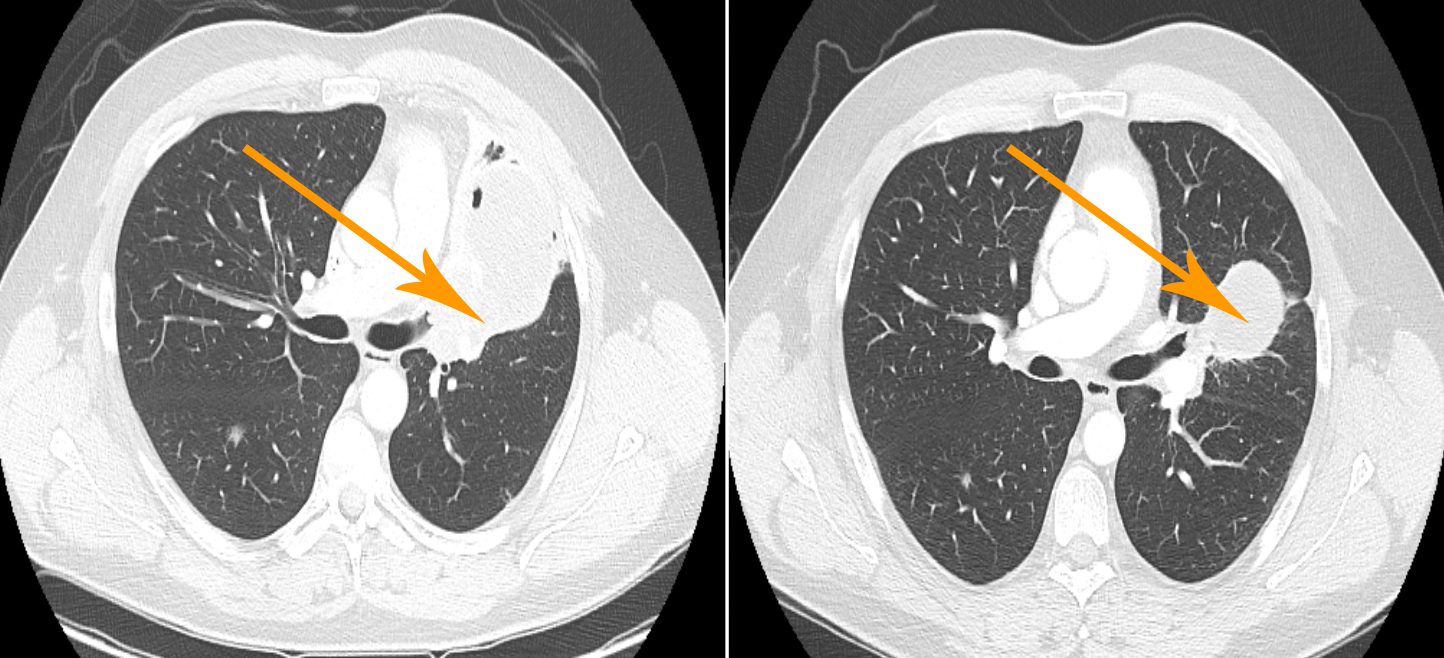
De acuerdo con los resultados incipientes de un ensayo en fase I, el inhibidor de quinasa BLU-667, que selectivamente se dirige al iniciador oncogénico “rearreglado durante la transfección” (RET, por sus siglas en inglés), está demostrando una actividad clínica prometedora contra los tumores sólidos con alteraciones del gen RET.
Las alteraciones de RET, que pueden encontrarse en casi cualquier tipo de cáncer, ocurren en la mayoría de los pacientes con cáncer tiroideo medular (MTC) y también se observan con frecuencia en pacientes con cáncer tiroideo papilar y cáncer de pulmón no microcítico (NSCLC, por sus siglas en inglés). Sin embargo, actualmente ningún medicamento que específicamente esté dirigido a RET está aprobado por la Administración de Alimentos y Medicamentos de los EE. UU.
“Existe una necesidad crítica no satisfecha de contar con fármacos eficaces contra los cánceres que tienen la alteración RET”, dijo el Dr. Vivek Subbiah, profesor adjunto del Departamento de Investigación de Tratamientos contra el Cáncer del MD Anderson Cancer Center de la Universidad de Texas.
El Dr. Subbiah es el investigador principal del MD Anderson en un ensayo clínico multiinstitucional (N.º 2016-1007) de BLU-667. El ensayo de aumento escalonado de dosis se encuentra actualmente inscribiendo a pacientes que tengan cualquier tipo de tumor sólido con una alteración RET y a pacientes que tengan MTC, independientemente de la condición en cuanto a RET. Todos los pacientes deben tener tumores irresecables y enfermedad avanzada; los pacientes con una mutación dirigible en EGFR, ALK o ROS1 están excluidos del ensayo.
El Dr. Subbiah dijo que los resultados iniciales del ensayo son alentadores. Entre 40 pacientes evaluables, todos ellos con cánceres alterados por RET, la tasa de respuesta objetiva (completa y parcial) fue de 45%. Las tasas de respuesta general fueron de 40% y 50% entre los pacientes con MTC y NSCLC, respectivamente. Al 6 de abril de 2018, 41 de 51 pacientes inscritos continúan recibiendo BLU-667.
La mayoría de los eventos adversos fueron de grado 1, que incluyen estreñimiento, niveles elevados de aspartato-aminotransferasa y alanina-aminotransferasa, diarrea y fatiga. Sin embargo, tres pacientes experimentaron eventos adversos de grado 3: niveles elevados de alanina-aminotransferasa, hipertensión y síndrome de lisis tumoral. Se comprobaron reducciones del tumor en un 83% de los pacientes evaluables tratados con dosis de al menos 60 mg/día.
En abril de 2018, el Dr. Subbiah, la Dra. Mimi Hu, profesora adjunta del Departamento de Neoplasia Endocrina y Trastornos Hormonales, y otros colegas publicaron sus datos preclínicos y sus datos clínicos iniciales sobre BLU-667 en Cancer Discovery (doi: 10.1158/2159-8290.CD-18-0338) y presentaron los resultados incipientes del ensayo en la Reunión Anual de la Asociación Americana de Investigación sobre el Cáncer (presentación N.º CT043).
OncoLog, Mayo-Junio 2018, Volumen 63, Números 5-6